Cuando el ozono se introduce en el organismo, se disuelve rápidamente (es diez veces más soluble que el oxígeno) en el agua del plasma, en los fluidos extracelulares, en la fina capa de agua que cubre la piel o en las mucosas del intestino, vagina, etc. Reacciona inmediatamente con diferentes biomoléculas generando un conjunto de mensajeros importantes [especies reactivas del oxígeno (ERO) y productos de oxidación lipídica (POL)] para luego desaparecer. En estas reacciones se generan peróxidos orgánicos, peróxido de hidrógeno (H2O2), ozónidos y aldehídos, los cuales en cantidades adecuadas y controladas ejercen diferentes acciones biológicas que le confieren al ozono un conjunto de propiedades terapéuticas (1, 2, 3-12). Esta cascada señalizadora Ozono-ERO-POL no es definitiva y aún quedan aspectos en ella por dilucidar, pero está claro que dentro de las terapias complementarias, la ozonoterapia es una de las que mejor explicada está desde el punto de vista bioquímico, fisiológico y farmacológico (1, 2, 12).
Se conoce que un exceso de radicales libres es dañino, sin embargo, el ozono induce un pequeño, controlado y transitorio estrés oxidativo, que lejos de producir daño estimula los sistemas de defensa antioxidante, aspecto este que no debe ser confundido con el estrés continuado y progresivo (estrés crónico) que se mantiene en muchas patologías. Este efecto precondicionante del ozono es capaz de reequilibrar el estado Redox alterado en el organismo por algún estímulo patológico (1, 7-10,13).
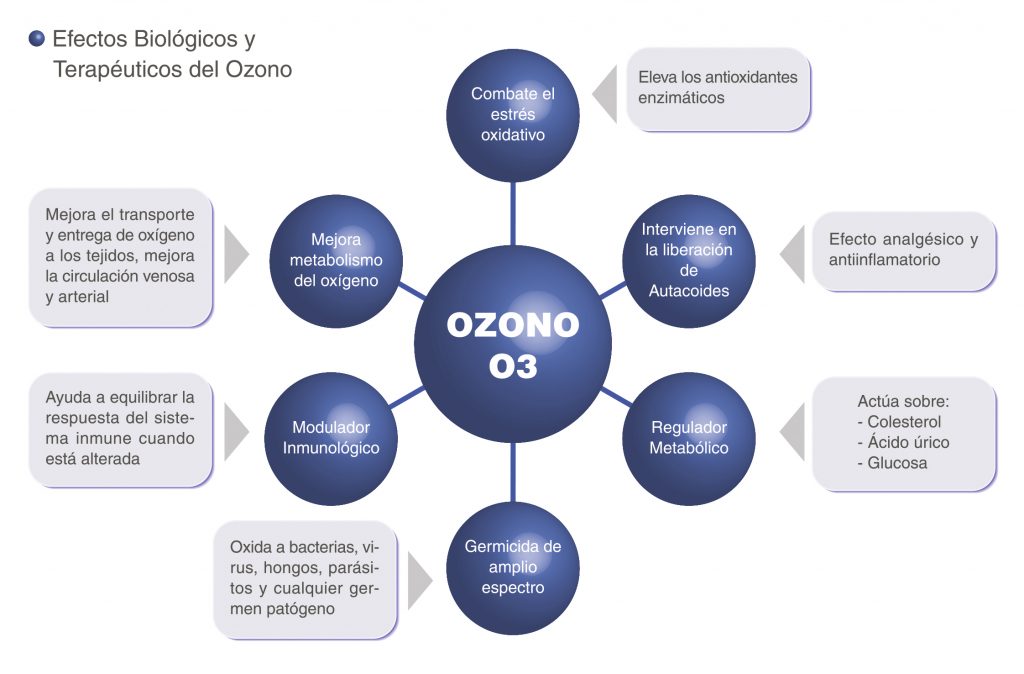
Otros de los efectos biológicos del ozono son: mejora la circulación sanguínea y los procesos de oxigenación, modula el sistema inmunológico, regula el metabolismo, efecto germicida (bactericida, virucida, fungicida y antiparasitario) e interviene inhibiendo la síntesis y liberación de autacoides o sea de mediadores químicos de la inflamación (1, 2, 12, 13).
Es importante recalcar que estas variadas acciones biológicas alcanzan resultados terapéuticos cuando el ozono es aplicado a dosis adecuadas y por una vía no dañina para el organismo (14). De este modo, no se producen reacciones adversas (15) ni daño genotóxico (16,17) y el amplio espectro de efectos que genera, hace posible su aplicación en una gran diversidad de especialidades médicas y dentro de estas, en una disímil variedad de procesos patológicos.
El ozono en el metabolismo del oxígeno:
El incremento en la velocidad de la glicólisis en el eritrocito va acompañado de un significativo aumento en el intercambio de iones sodio y potasio, los cuales son los responsables de mantener el potencial eléctrico de membrana, normalizando el intercambio de tales iones. Las enfermedades arteriales oclusivas están relacionadas con la pérdida del potencial normal de la membrana plasmática eritrocitaria. La normalización del intercambio de iones, por el ozono y sus productos,
favorece la restauración del potencial normal. Por consiguiente, la regeneración de las condiciones eléctricas normales de la membrana propicia recuperar la flexibilidad y plasticidad de los eritrocitos mejorando de esta forma, las propiedades reológicas de la sangre, lo cual favorece consecuentemente el transporte de oxígeno (1, 2, 3, 12).
La selectiva reactividad del ozono para la formación de POL y ERO facilita la activación directa del metabolismo eritrocitario. Iles and Liu (18) han demostrado que los POL, específicamente el 4-hidroxi-2,3-trasnonenal, provoca un incremento intracelular del glutatión reducido (GSH) por inducción de la glutamato cisteína ligasa, acción con la que desempeñan un papel importante en los mecanismos de defensa antioxidante. Mediante la vía de destoxificación (el H2O2 es reducido a agua y los lipoperóxidos a hidroperóxidos, mucho menos reactivos) por el sistema del glutatión tiene lugar una activación de la glicólisis con resultados directos sobre la elevación de la concentración del 2,3-difosfoglicerato (2,3-DPG), el incremento del intercambio iónico a nivel de membrana y la producción final de energía en forma de ATP. El 2,3-DPG tiene ciertas funciones clave, entre ellas, actuar sobre la desaturación del oxígeno de la oxihemoglobina provocando una mayor cesión de este a los tejidos vecinos.
El aumento de la oxigenación y los efectos beneficiosos de la ozonoterapia en las enfermedades isquémicas pudiera estar asociado a la microliberación de ATP de los eritrocitos y a la vasodilatación encontrada (1, 2, 12, 19).
El ozono como agente estabilizador del balance redox celular
Aunque la producción de ERO en el organismo es parte del metabolismo biológico normal y es además, un fenómeno necesario para el adecuado funcionamiento de un conjunto de procesos vitales (por ejemplo, la fagocitosis), el incremento no controlado de estos productos está estrechamente vinculado a la patogenia de una amplia variedad de enfermedades (20-25), así como al envejecimiento (26). En el organismo están presentes mecanismos de defensa antioxidante capaces de mantener un adecuado balance frente a estos potentes agentes oxidantes (1, 27, 25). Para contrarrestar los efectos desfavorables que las ERO originan, se encuentran los sistemas antioxidantes enzimáticos y no-enzimáticos. Entre los primeros se encuentran las enzimas superóxido dismutasa (SOD), catalasa (CAT), glutatión peroxidasa (GPx) y glutatión S-transferasa (GST) que constituyen las primeras líneas de protección (1, 27, 7, 28). Entre los sistemas no-enzimáticos que actúan como secuestradores de varias ERO se tiene el glutatión reducido (GSH), que también funciona como cofactor de varias enzimas antioxidantes, las vitaminas E, C y A, el ácido úrico, la coenzima Q, el ácido lipoico y algunas proteínas plasmáticas. Por lo tanto, la excesiva producción de metabolitos del oxígeno o una inadecuada defensa para contrarrestar su acumulación en el organismo, con la injuria tisular consecuente, favorece o acelera el desarrollo de múltiples procesos patológicos.
Se formula, por primera vez, la hipótesis de un nuevo mecanismo de acción para el ozono terapéutico, partiendo de su carácter oxidante que origina un estrés oxidativo, débil y transitorio (al que se denominó Precondicionamiento Oxidativo)
que, en respuesta, “dispara” los sistemas antioxidantes endógenos permitiendo enfrentar estados de enfermedad que presenten como elemento común una pérdida del balance antioxidante/prooxidante, entre éstos: desórdenes vasculares cardíacos, cerebrales, complicaciones diabéticas macroangiopáticas y otras), desórdenes inmunológicos autoinmunidad, tumores, infecciones, inmunodepresión,), del SNC, etc (7). Las investigaciones desarrolladas en Cuba, tanto en animales (7,9,10,29-41) como en humanos (8,27,28,42,43) han permitido demostrar, que la ozonoterapia ejerce un efecto estimulador o activador de los sistemas de defensa antioxidante contra la acción de las ERO. Se han estudiado diferentes modelos animales, que resaltan el efecto perjudicial del exceso de ERO, como el de tetracloruro de carbono (CCl4) administrado intraperitonealmente (7,39), los de isquemia-reperfusión, tanto en hígado (36-38,40,41) como en riñón (10,29,30), los de insuficiencia renal aguda (11, 31-33) y crónica (10), el de diabetes (34,35), el de sepsis (9), los cuales han demostrado la capacidad del ozono de lograr el balance redox celular. También se ha demostrado en humanos, que la ozonoterapia ejerce un efecto estimulador del sistema de defensa de la glutatión peroxidasa eritrocitaria en pacientes con insuficiencia arterial crónica, con cardiopatía isquémica o asmáticos (27, 28, 43). Por otra parte, se han observado en pacientes con degeneración macular relacionada con la edad, tratados con ozono, un incremento de la superóxido dismutasa manganeso dependiente (Mn-SOD) (42).
En la diabetes, uno de los eventos asociados a la hiperglicemia y al estrés oxidativo es la pérdida de los sistemas antioxidantes endógenos (44,45,46-52). El estrés oxidativo parece participar, de manera importante, en la iniciación de la cascada de eventos fisiopatológicos que dan origen a las complicaciones diabéticas, en particular a las vasculares, considerándose un factor patogénico en la progresión de la enfermedad (53,54). En pacientes diabéticos, se ha observado una disminución de sus defensas antioxidantes, tanto enzimáticas (SOD, CAT y GPx) como no enzimáticas (vitaminas A, C, E), lo que provoca un incremento del daño oxidativo (44). Pacientes diabéticos tipo 2 con pie diabético neuroinfeccioso, tratados con ozono, han logrado un incremento significativo en la actividad de la catalasa y la superóxido dismutasa, con disminuciones significativas del contenido de hidroperóxidos totales y de la fructolisina (indicador de la formación de productos de glicosilación avanzada), de los productos avanzados de la oxidación de proteínas, así como también, una disminución significativa en la glucosa plasmática (lo que demostró un mejoramiento del control glicémico) y la preservación de la integridad de los islotes pancreáticos (8). El mantenimiento de los sistemas antioxidantes endógenos y la disminución en la generación de ERO, favorece un adecuado balance Redox celular, lo cual sugiere que la reducción de la hiperglicemia en estos pacientes diabéticos tipo 2, pudiera estar relacionado con un incremento en la sensibilidad a la insulina, actuando sobre las vías de señalización mediada por la hormona (55). Evidencias clínicas revelan la existencia de una estrecha asociación entre el estrés oxidativo y la sensibilidad a la insulina (51,52). De hecho, se ha demostrado que el empleo del antioxidante ácido lipoico mejora la utilización de la glucosa y la resistencia a la insulina (56). Por otra parte, existen evidencias de que en la diabetes ocurre una disfunción endotelial, hecho que sugiere una disminución en la producción de óxido nítrico en el endotelio de los pacientes que la padecen (57). Sin embargo, los pacientes tratados con ozono lograron restablecer los niveles de óxido nítrico (8).
Además, en estos pacientes diabéticos tratados con ozono se aceleró la cicatrización de sus lesiones, disminuyó el número de amputaciones, el tiempo de estadía hospitalaria y los gastos por concepto de salud.
La propiedad del ozono de estimular los sistemas de defensa antioxidante logrando restablecer el balance Redox celular lo hace útil en el tratamiento de diferentes enfermedades.
El ozono como agente modulador de la respuesta inmune
El ozono ha sido considerado como un agente inductor ideal de citocinas, ya que es de escasa toxicidad demostrada hasta el presente, no antigénico y produce una respuesta inmune positiva sin efectos adversos, cuando se emplea con cautela y bajo condiciones controladas (1, 2, 4, 11, 12, 14). El ozono es capaz de estimular un cierto número de células del sistema inmune, las cuales pueden liberar una pequeña cantidad de citocinas inmunoestimuladoras e inmunosupresoras (2) que son captadas por células vecinas, manteniendo el sistema inmune en estado alerta, usualmente sin ningún desbalace entre activación y supresión (acción inmunomoduladora). Estudios 219, 220 realizados en Cuba que evidencian el efecto modulador del ozono sobre la expresión de ciertas citocinas, como por ejemplo el Factor de Necrosis Tumoral FNT, han sido llevados a cabo en el modelo experimental de shock endotóxico inducido por lipopolisacárido (LPS). Este efecto inhibidor del ozono sobre el FNT puede ser una consecuencia de la estimulación de los sistemas de defensa antioxidantes inducidos por la ozonoterapia (9,58). Se conoce que las ERO están fuertemente involucradas en la inducción de los procesos inflamatorios y en la patogénesis del shock endotóxico, así como en el efecto de los agentes antioxidantes en la inhibición del Factor de Transcripción Nuclear (NFB) (59,60). Esta característica moduladora atribuible a la ozonoterapia, se revela en algunos de los hallazgos clínicos, que aunque aparentemente paradójicos, se observan en el tratamiento a pacientes con afecciones de tipo inmunológico. Se conocen resultados satisfactorios al aplicar este método terapéutico tanto a pacientes con afecciones caracterizadas por una respuesta inmunológica exagerada, como en las enfermedades consideradas de etiología autoinmune (61), así como en otros con déficit de sus funciones inmunológicas (62,63).
El ozono en la síntesis y liberación de autacoides
La palabra autacoide deriva del griego “autos” (propio) y del vocablo “akos” (agente medicinal o remedio) y se considera como tal a un grupo de sustancias con diversas acciones fisiológicas y farmacológicas, las cuales participan en muchos eventos fisiológicos o patológicos. Dos familias diferentes de autacoides derivadas de los fosfolípidos de las membranas celulares han sido identificadas: los eicosanoides (se deriva del griego eikosi, que significa veinte), formados a partir de ciertos ácidos grasos poliinsaturados (principalmente ácido araquidónico), en los que se incluyen las prostaglandinas, prostaciclina, el tromboxano A2 y los leucotrienos, y otros fosfolípidos modificados representados por el factor activador de plaquetas. Estos compuestos tienen una gran importancia biológica y han sido detectados en casi todos los tejidos y fluidos del cuerpo. Su producción se incrementa en respuesta a diversos estímulos, originándose un amplio espectro de efectos en el organismo (64). Se conoce un conjunto de trabajos referentes a la interacción del ozono y los metabolitos del ácido araquidónico, cuando el gas es aplicado por inhalación, condiciones en que se reconoce a los eicosanoides como uno de los elementos responsables de la toxicidad pulmonar tras la exposición al ozono por esta vía (65,66). Muy poco se ha estudiado acerca de los efectos del ozono aplicado por una vía diferente a la respiratoria y el estado de los metabolitos del ácido araquidónico, especialmente en humanos. Sin embargo, resulta de gran interés este tema, puesto que al ozono se le confieren propiedades antiinflamatorias, analgésicas y vasodilatadoras que pudieran estar relacionadas con estos eicosanoides. En un estudio realizado en pacientes portadores de diferentes enfermedades (asma bronquial, atrofia del nervio óptico, demencia senil, glaucoma y osteoartrosis) tratados con ozono se les determinaron las concentraciones de tromboxano B2 (TxB2), metabolito estable del tromboxano A2 (TxA2) y prostaciclina PGI2 (medida a través del 6 ceto PGF1). Se observó que las concentraciones de TxB2 tendieron a disminuir y la 6 ceto PGF1 a aumentar, mientras que su relación disminuyó significativamente después del tratamiento (67). Las propiedades vasoactivas de los metabolitos del ácido araquidónico se encuentran entre sus más llamativas acciones (68). La PGI2 es vasodilatadora mientras que el TXA2 es un vasoconstrictor para la mayoría de los lechos vasculares. Estos efectos parecen deberse a una acción directa sobre el músculo liso de la pared vascular. Siempre que se mantenga la presión arterial sistémica, los metabolitos del ácido araquidónico incrementan el flujo. En este caso, el tratamiento con ozono pudo ser capaz de disminuir el TxB2 y aumentar la PGI2, con lo que la relación TxB2/6 ceto PGF1 disminuiría, incrementando su efecto vasodilatador.
El ozono como regulador metabólico
La acción reguladora del ozono sobre el metabolismo del organismo humano ha sido sustentada sobre la base de observaciones preclínicas y clínicas realizadas. En ellas, se ha apreciado una modulación de los indicadores inicialmente patológicos hacia valores normales. Dentro de estos indicadores metabólicos estudiados se encuentran: glucosa, creatinina, hemoglobina, hematocrito, proteínas totales, lactato deshidrogenasa, colesterol, triglicéridos, lipoproteínas, enzimas hepáticas, bilirrubina, ácido úrico, ácido láctico y calcio, entre otras (1, 7, 8, 14, 27, 29-41, 43, 69, 70).
Por ejemplo, en pacientes con cardiopatía isquémica tratados con ozono se observó una disminución estadísticamente significativa del colesterol (COL) y de las lipoproteínas de baja densidad (LDL) en el plasma (10). Similares resultados se han obtenido, en cuanto a la modulación de las concentraciones de creatinina, en pacientes con insuficiencia renal crónica en estadios 4 y 5 de la enfermedad tratados con ozono.
Propiedades germicidas del ozono.
El ozono es reconocido en el mundo como uno de los agentes germicidas más poderosos (1). Él es capaz de eliminar virus, bacterias, hongos y parásitos. Esta propiedad lo ha hecho útil en enfermedades infecciosas de variada etiología, alcanzándose en procesos agudos sépticos resultados muy favorables. En el campo de la Medicina, en 1915 A. Wolf comienza a utilizar el ozono, teniendo en cuenta su carácter germicida, en el tratamiento local de fístulas, úlceras por decúbito, heridas infectadas, así como en la osteomielitis. (1, 71)
La acción germicida (bactericida, virucida y fungicida) de amplio espectro del ozono permite que la ozonoterapia sea un valioso tratamiento para la limpieza y desinfección de heridas infectadas y otros procesos sépticos locales.
Además, esta forma de aplicación puede ser combinada con otros procedimientos también derivados de las aplicaciones del gas (ozonoterapia sistémica y curaciones locales con agua y aceites vegetales ozonizados) sin el peligro de resistencia de los microorganismos, ni de toxicidad o efectos adversos y con la ventaja de resultados curativos más precoces en afecciones en las que la evolución puede ser de semanas o incluso meses (1, 2, 3). Por ejemplo, se observó que el ozono utilizado precozmente, en pacientes en estado crítico, evita en gran medida la sepsis respiratoria y en los casos que se hace manifiesta la utilización de antibióticos conjuntamente con el ozono contribuye a que sea de menor magnitud y de más fácil control. Además, se evidenció una mejoría en los indicadores hemodinámicos, un aumento de la oxigenación tisular y en la saturación de la hemoglobina, una disminución de la acidosis metabólica y una normalización de la glucosa (72). Por otra parte, se conoce que el uso indiscriminado de antibióticos de amplio espectro ha incrementado la resistencia de los microorganismos a ellos, y a su vez, aumentado la frecuencia de aparición de las infecciones nosocomiales y ejercido un impacto directo en la incidencia de la sepsis generalizada (73). Todo ello contribuye a la aparición de complicaciones severas y a un pronóstico desfavorable para la mayoría de esos pacientes. Cuando existe una infección o una inflamación estamos en presencia de un estrés oxidativo crónico, con un desbalance progresivo entre los antioxidantes (que se reducen) y los prooxidantes (que se incrementan), capaz de inducir una apoptosis celular generalizada con la consecuente muerte del paciente (74). Además, los leucocitos y macrófagos generan cantidades excesivas de ERO, las cuales eliminan a los patógenos, pero también, a las células normales. De ahí, la importancia de la modulación de las ERO (75).
Con todos los resultados alcanzados hasta el momento, se puede considerar a la ozonoterapia como una terapia coadyuvante capaz de revertir o hacer mínimas las complicaciones en un enfermo crítico. Por tanto, sería ideal como terapia profiláctica en este tipo de pacientes.
Teniendo en cuenta todas las propiedades terapéuticas del ozono, se ha destacado el papel de la ozonoterapia, bien como coadyuvante de la terapia convencional o dando una solución (aumento de la calidad de vida o retardo de la evolución de la enfermedad), en aquellas donde la medicina ortodoxa no ha brindado resultados positivos. Es por ello que la ozonoterapia forma parte hoy día de las estrategias terapéuticas en todo el mundo.Todos los esfuerzos dirigidos a aumentar la calidad de vida de nuestros pacientes y el bienestar de los mismos constituyen un nuevo avance dentro de las Ciencias Médicas.
Bibliografía
1. Menéndez S, González R, Ledea OE, Hernández F, León OS, Díaz M: Ozono. Aspectos básicos y aplicaciones clínicas. La Habana, Cuba: Editorial CENIC, 2008:10-320.
2. Bocci V: Oxygen-Ozone Therapy. A critical evaluation. AA Dordrecht, The Netherlands: Kluwer Academic Publishers, 2002: 31-374.
3. Viebahn R: The use of ozone in Medicine. 5th English ed. Iffezheim, Germany: ODREI-Publishers, 2007: 14-140.
4. Bocci V. Ozonization of blood for the therapy of viral diseases and immunodeficiencies. A hypothesis. Med Hypotheses 1992; 39: 30-34.
5. Bocci V. A reasonable approach for the treatment of HIV infection in the early phase with ozonetherapy autohemotherapy). How “inflammatory” cytokines may have a therapeutic role. Mediat Inflamm 1994; 3: 315-321.
6. Bette M, Mutters R, Nusing RM, Rodríguez ZZ, Menéndez S, Schulz S. Efficiency of Piperacillin/Tazobactam in lethal peritonitis is enhanced after preconditioning of rats with an oxidative stressor. Shock 2006; 25(1): 23-29.
7. León OS, Menéndez S, Merino N, Castillo R, Sam S, Pérez L, et al. Ozone oxidative preconditioning: a protection against cellular damage by free radicals. Med Inflamm 1998; 7: 289-294.
8. Al-Dalain SM, Martínez G, Menéndez S, Re L, Giuliani A, Candelario-Jalil E, et al. Therapeutic efficacy of ozone medical treatments in patients with diabetic foot. Eur J Pharmacol 2005; 523: 151-161.
9. Zamora Z, Borrego A, López O, Delgado R, González R, Menéndez S, et al. Effects of ozone oxidative preconditioning on TNF-? release and antioxidant-prooxidant intracellular balance in mice during endotoxic shock. Mediat Inflamm 2005; 1; 16-22.
10. Calunga JL, Zamora ZB, Borrego A, del Río S, Barber E, Menéndez S, et al. Protective Effect of Ozone/Oxygen Mixture on Rats Submitted to Subtotal Nephrectomy: Role of Antioxidant System. Mediat Inflamm. 2005; 4: 221-227.
11. Bocci V. Scientific and medical aspects of ozone therapy. State of the art. Arch Med Research. 2006; 37: 425-435.
12. Bocci V: Ozone. A new medical drug. AA Dordrecht, The Netherlands: Springer Publishers, 2005: 5-234.
13. Calunga JL, Trujillo Y, Menéndez S, Zamora Z, Alonso Y, Merino N, et al. Ozone oxidative postconditioning in acute renal failure. J Pharm Pharmacol 2009; 61: 1-6.
14. Bocci V. Ozone as a bioregulator. Pharmacology and toxicology of ozonetherapy today. J Biol Reg Homeos Ag 1997; 10(2/3): 31-53.
15. Jacobs MT. Zwischenfalle und typische komplikationen in der Ozon-Sauerstoff-Therapie. Atti Congresso sull’Ozono; Baden-Baden, 1981: 20.
16. Díaz S, González Y, Prieto EA, Azoy A. Genotoxic effect of ozone in human peripheral blood leukocyte. Mutat Res-Gen Tox En 2002; 517: 13-20.
17. González R, Romay Ch, Díaz S. Sobre genotoxicidad del ozono. Rev Cubana Invest Biomed 2004; 23(3): 177-183.
18. Iles KE, Liu RM. Mechanisms of glutamate cysteine ligase GCL) induction by 4-hydroxynonenal. Free Radical Biol Med 2005; 38: 547-556.
19. Valacchi G, Bocci V. Studies on the biological effects of ozone: 11. Release of factors from human endothelial cells. Mediat Inflamm 2000; 9: 271-276.
20. Halliwell B, Cross CE. Oxygen-derived species: Their relation to human disease and environmental stress. Env Health Persp 1994; 102(Suppl 10): 5-12.
21. Knight JA. Diseases related to oxygen-derived free radicals. Ann Clin Lab Sci 1995; 25(2): 111-121.
22. Jarjour N, Callhouh WJ. Enhanced production of oxygen radicals in asthma. J Lab Clin Med 1994; Jan: 131-136.
23. Wright DT, Cohn LA, Li H, Fischer B, Ming C, Adler KB. Interactions of oxygen radicals with airway epithelium. Env Health Persp 1994; 20(Suppl 10): 85-90.
24. Rothstein JD, Bristol LA, Hosler B, Brown RH Jrs, Kuncl RW. Chronic inhibition of superoxide dismutase produces apoptotic death of spinal neurons. Proc Natl Acad Sci USA 1994; 91: 4155-4159.
25. Winklhofer-Roob BM. Oxygen free radicals and antioxidant in cystic fibrosis: the concept of an oxidant-antioxidant imbalance. Acta Paediatr 1994; 395: 49-57.
26. Harman D. Aging: prospects for further increases in the functional life span. Age 1994; 17: 119-126.
27. Hernández F, Menéndez S, Wong R. Decrease of blood cholesterol and stimulation of antioxidative response in cardiopathy patients treated with endovenous ozone therapy. Free Radical Bio Med 1995; 19(1): 115-119.
28. Hernández F, Menéndez S, Eng L. Efecto de la ozonoterapia intravascular sobre el sistema de la glutatión peroxidasa. Rev. CENIC Ciencias Biológicas (Cuba) 1989; 20: 37-40.
29. Barber E, Menéndez S, León OS, Barber MO, Merino N, Calunga JL, et al. Prevention of renal injury after induction of ozone tolerance in rats submitted to warm ischaemia. Mediat Inflamm 1999; 8: 37-41,.
30. Calunga JL, Menéndez S, Barber E, Merino N, Cruz E. Ozone biological response in kidneys of rats submitted to warm ischemia. Ozone-Sci Eng 2003; 25(3): 233-240.
31. Borrego A, Zamora Z, González R, Romay C, Menéndez S, Hernández F, et al. Protection by ozone preconditioning is mediated by antioxidant system in cisplatin induced nephrotoxicity in rats. Mediat Inflamm 2004; 13(1): 13-19.
32. González R, Borrego A, Zamora Z, Romay C, Hernández F, Menéndez S, et al. Reversion by ozone treatment of acute nephrotoxicity induced by cisplatin in rats. Mediat Inflamm 2004; 13(5/6): 307-312.
33. González R, Romay Ch, Borrego A, Hernández F, Merino N, Zamora Z, et al. Lipid peroxide and antioxidant enzymes cysplatin-induced chronic neprotoxicity in rats. Mediat Inflamm 2005; 14(3): 139-143.
34. Martínez G, Al-Dalain SM, Menéndez S, Giuliani A, León OS. Ozone treatment reduces blood oxidative stress and pancreas damage in a streptozotocin-induced diabetes model in rats. Acta Farm Bonaerense 2005; 24(4): 491-497.
35. Al-Dalain SM, Martínez G, Candelario-Jalil E, Menéndez S, Re L, Giuliani A, et al. Ozone treatment reduces markers of oxidative and endothelial damage in an experimental diabetes model in rats. Pharmacol Res 2001; 44(5): 391-396.
36. Ajamieh HH, Berlanga J, Merino N, Martínez Sánchez G, Candelario-Jalil E, Menéndez S, et al. Role of protein synthesis in the protection conferred by ozone oxidative preconditioning in hepatic ischemia/reperfusion. Transpl Int 2005; 18: 604-612
37. Ajamieh HH, Menéndez S, Merino N, Martínez G, Re L, León OS. Ischemic and ozone oxidative preconditioning in the protection against hepatic ischemic-reperfusion injury. Ozone-Sci Eng 2003; 25(3): 241-250.
38. Ajamieh HH, Merino N, Candelario-Jali E, Menéndez S, Martínez G, Re L et al. Similar protective effect of ischemic and ozone oxidative preconditionings in liver ischaemia/reperfusion injury. Pharmacol Res 2002; 45(4): 333-339.
39. Candelario-Jalil E, Mohammed-Al-Dalain S, León OS, Menéndez S, Pérez G, Merino N et al. Oxidative preconditioning affords protection against carbon tetrachloride-induced glycogen depletion and oxidative stress in rats. J Appl Toxicol 2001; 21: 297-301.
40. Peralta C, Xaus C, Bartrons R, León OS, Gelpi E, Roselló-Catafau J. Effect of ozone treatment on reactive oxygen species and adenosine production during hepatic ischemia-reperfusion. Free Radical Res 2000; 33: 595-605.
41. Peralta C, León OS., Xaus C, Prats N, Jalil EC, Sala-Planell E et al. Protective effect of ozone treatment on the injury associated with hepatic ischemia-reperfusion: antioxidant-prooxidant balance. Free Radical Res 1999; 31: 191-196.
42. Riva Sanseverino E, Meduri RA, Pizzino A, Prantera M, Martini E. Effects of oxygen-ozone therapy on age-related degenerative retinal maculopathy. Panminerva Med 1990; 32: 77-84.
43. Hernández F, Calunga JL, Turrent J, Menéndez S, Montenegro A. Ozone therapy effects on blood biomarkers and lung function of asthma patients. Arch Med Res 2005; 36(5): 549-554.
44. West IC. Radicals and oxidative stress in diabetes. Diabet Med 2000; 17: 171-80.
45. Yoshida K, Hirokawa J, Tagani S, Kawakani Y, Urata Y, Kondo T. Weakened cellular scavenging activity against oxidative stress in diabetes mellitus: regulation of glutathione synthesis and efflux. Diabetología 1995; 38: 201-210.
46. Ceriello A, Mercuri F, Quagliano L, Assaloni R, Motz E. Detection of nitrotynosive in the diabetic plasma: evidence of oxidative stress. Diabetología 2001; 44(7): 834-838.
47. Sozmen EY, Sozmen B, Denle Y, Onat T. Catalase/superoxide dismutase (SOD) and catalase/paraoxanase (pon) ratios may implicate poor glycemic control. Arch Med Res 2001; 32(4): 283-287.
48. Keenoy MB, Vertmmen J, De Leeuw I. Divergent effects of different oxidants and glutathione homeostasis and protein damage in erythrocytes from diabetic patients: effects of high glucose. Mol Cell Biochem 2001; 225(1): 59-73.
49. Peiro C, La Fuente N. High glucose induces cell death of cultured human dontic smooth muscle cells through the formation of hydrogen peroxide. Br J Pharmacol 2001; 133(7): 967-974.
50. Santo MS, Santos DL. Brain and liver mitochondria isolated from diabetes Goto-Kakisaki rats show different suceptibility to induced oxidative stress. Diabetes-Metab Res 2001; 17(3): 223-230.
51. Salonen JT, Nyssonen K. Increased risk of non-insulin dependent diabetes mellitus at low plasma vitamin E concentrations: a four year follow up study in men. Br Med J 1995; 311: 1124-1127.
52. Ceriello A. Oxidative stress and glycemic regulation. Metabolism 2001; 49(2): 27-29.
53. Guigliano D, Ceriello A. Oxidative stress and diabetic vascular complication. Diabetes 1996; 19: 257-267.
54. Bayanes JW. Role of oxidative stress in development of complication in diabetes. Diabetes 1991; 40: 405-411.
55. Rodríguez MM, García JR, Menéndez S, Devesa E, Valverde S. Ozonoterapia en la enfermedad cerebro-vascular isquémica. Revista CENIC Ciencias Biológicas (Cuba) 1998; 29(3): 145-148.
56. Khamisi M, Potashnik R. Lipoic acid reduces glycemic and increase muscle GLUT-4 content in streptozotocin diabetic rats. Metabolism 1997; 46: 763-768.
57. Pieper GM, Dembny K, Siebeneich W. Long-term treatment in vivo with NOX-101, a scavenger of nitric oxide, prevents diabetes-induced endothelial dysfunction. Diabetología 1998; 41: 120-126.
58. Zamora Z, Borrego A, López O, Delgado R, Menéndez S, Schulz S. Inhibition of TNF-alpha release during endotoxic shock by ozone oxidative preconditioning in mice. Arzneim-Forsch Drug Res 2004; 54(2): 906-909.
59. Klosterhalfen B Bhardwaj RS. Septic shock. Gen Pharmacol 1997; 31(1): 25-32.
60. Novelli GP. Role of free radicals in septoc shock. J Physiol Pharmacol 1997; 48(4): 517-527.
61. Fahmy Z. Correlation of plasma interleukin 1 levels with disease activity in rheumatoid arthritis with and without ozone In: International Ozone Association, editors. Proceedings of the 12th Ozone World Congress; 1995 May 15-18; Lille, France: International Ozone Association; 1995. Ozone in Medicine: 195-205.
62. Menéndez S, Iglesias O, Bidot C, Puga A, Carballo A. Application of ozone therapy in children with humoral immunity deficiency. In: International Ozone Association, editors. Proceedings of the 12th Ozone World Congress; 1995 May 15-18; Lille, France. International Ozone Association; 1995. Ozone in Medicine: 271-274.
63. Ramos J, Torres M, Aguilar E, Ostolaza A, Gómez M, Menéndez S et al. Estudio inmunológico de 25 pacientes grandes quemados tratados con ozono. Revista CENIC Ciencias Biológicas (Cuba) 1989; 20: 116-120.
64. Hardman JG, Limbird LE, Goodman Gilman A, editors. Goodman and Gilman’s. The pharmacological basis of therapeutics. Eighth Edition. USA: Pergamon Press, 1990: 574, 600, 606.
65. Friedman M, Madden MC, Samet JM, Koren HS. Effects of ozone exposure on lipid metabolism in human alveolar macrophages. Environ Health Perspect. 1992; 97:95-101.
66. Weideman PA, Schlesinger RB. Effect of in vitro exposure to ozone on eicosanoid metabolism and phagocytic activity of human and rabbit neutrophils. Inhal Toxicol 1994; 6: 43-55.
67. López R, Cabezas O, León OS. Efecto profiláctico del ozono sobre los niveles de calcio y otros mediadores del estrés oxidativo en fracciones subcelulares hepáticas e influencia de los eicosanoides sobre el precondicionamiento oxidativo. Actas del 3 Simposio Internacional de Aplicaciones del Ozono; 2000, Junio 27-30; Ciudad de La Habana, Cuba: Editorial CENIC, 2000.
68. Isselbacher KJ, Braunwald E, Wilson JD, Martin JB, Fauci AS, Kasper DL editores. Harrison. Principios de Medicina Interna. 13ra Edición. Vol. 1. México: McGraw-Hill Interamericana, 1994: 505-506.
69. León OS, Menéndez S, Merino N, López R, Castillo R, Sam S et al. Influencia del precondicionamiento oxidativo con ozono sobre los niveles de calcio. Revista CENIC Ciencias Biológicas (Cuba) 1998; 29(3): 134-136.
70. Borrego A, Zamora Z, González R, Romay Ch, Menéndez S, Hernández F et al. Ozone/Oxygen mixture modifies the subcellular redistribution of Bax protein in renal tissue from rats treated with cisplatin. Arch Med Res 2006; 37: 717-722.
71. Menéndez S, Peláez O, Gómez M, Copello M. Aplicación de la ozonoterapia en la retinosis pigmentaria. Informe preliminar. Rev Cubana Oftalmol 1990; 3(1): 35-39.
72. Rabell S, Menéndez A, Alonso PL, Gutiérrez F, Valdés J, Díaz A et al. La terapia con ozono y la prevención de la sepsis en el enfermo crítico. Revista CENIC Ciencias Biológicas (Cuba) 1989; 20: 124-127.
73. Opal SM, Cohen J. Clinical gram-positive sepsis: does it fundamentally differ from Gram-negative bacterial sepsis? Crit Care Med 1999; 27: 1608-1616.
74. Bocci V, Brito GS. Ozone therapy in critical patients. Rationale of the therapy and proponed guidelines. Riv Italiana di Ossigeno-Ozonoterapia 2006; 5: 7-11.
75. Magder S. Reactive oxygen species: toxic molecules or spark of life? Crit Care 2006; 10: 208-218.